अमोनिया
अमोनिया (ammonia in Hindi) का रासायनिक सूत्र NH3 होता है। यह सूक्ष्म मात्रा में वायु में उपस्थित रहती है। जहां जीव जंतुओं का शरीर सड़ जाता है उन स्थानों पर इसकी अधिकता पाई जाती है।
अमोनिया बनाने की विधि
वैसे तो अमोनिया गैस को बनाने की अनेकों विधियां हैं। लेकिन दो विधियां महत्वपूर्ण हैं एवं परीक्षाओं में भी इन्हीं दोनों में से कोई एक विधि पूछी जाती है। अमोनिया बनाने की दोनों विधियां निम्न प्रकार से हैं।
1. प्रयोगशाला विधि
2. हैबर विधि
1. अमोनिया बनाने की प्रयोगशाला विधि
प्रयोगशाला में अमोनिया, नौसादर को बुझे हुए चूने के साथ गर्म करके बनाई जाती है।
\scriptsize \begin{array}{rcl} 2NH_4Cl \\ अमोनियम\,क्लोराइड \end{array} + Ca(OH)2 \xrightarrow {∆} \scriptsize \begin{array}{rcl} 2NH_3 \\ अमोनिया \end{array} CaCl2 + 2H2O

जैसा चित्र में दिखाया गया है। कि एक फ्लास्क में 2 : 1 के अनुपात में नौसादर और बुझे हुए चूने का मिश्रण लेते हैं। इसमें एक छेद वाली कॉर्क लगाकर उस कॉर्क में दो बार समकोण पर मुड़ी एक निकास नली लगा देते हैं इस नली का दूसरा सिरा बुझे हुए चूने से भरी बोतल से जोड़ दिया जाता है। इसमें से एक नली लगाकर उसे एक उल्टे जार से जोड़ देते हैं। जैसे ही फ्लास्क को धीरे-धीरे गर्म करते हैं तो अमोनिया गैस बनती है। जिसे बुझे हुए चूने से प्रवाहित किया जाता है जिससे नमी अवशोषित हो जाती है। और अंत में अमोनिया वायु की अधोमुखी विस्थापन द्वारा गैस जार में एकत्रित कर ली जाती है।
2. अमोनिया बनाने की हैबर विधि
व्यापक स्तर पर अमोनिया हाॅबर प्रक्रम द्वारा बनाई जाती है। जिस कारण इसे अमोनिया का औद्योगिक निर्माण भी कहते हैं। इस विधि द्वारा अमोनिया बड़े पैमाने पर बनाई जाती है।
इस विधि में नाइट्रोजन तथा हाइड्रोजन के 1 : 3 के अनुपात के मिश्रण को गर्म करके अमोनिया बनाई जाती है।
N2 + H2 \rightleftharpoons 2NH3 + 22.4 किलोकैलोरी
चूंकि अमोनिया के निर्माण में ऊष्मा मुक्त होती है एवं आयतन में कमी होती है। अतः ला-शातेलिए नियम के अनुसार कम ताप एवं उच्च दाब पर अमोनिया अधिक मात्रा में उत्पन्न होगी।
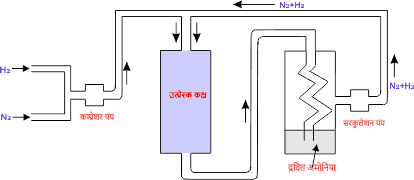
हैबर विधि में N2 तथा H2 को 1 : 3 के अनुपात में मिलाकर 200 वायुमंडलीय दाब पर तथा 500°C ताप पर लोहे के चूर्ण उत्प्रेरक, जिसमें मोलिब्डेनम उत्प्रेरक वर्धक मिला होता है। के साथ उत्प्रेरक कक्ष में गर्म करते हैं इसमें प्राप्त अमोनिया को संघनित्र में प्रवाहित करके द्रवित कर लेते हैं शेष गैस को पुनः उत्प्रेरक कक्ष में प्रवाहित करते हैं जिससे अमोनिया का लगातार उत्पादन होता रहता है।
Note –
अमोनिया को बनाने की और भी विधियां हैं। जैसे अमोनियम लवण से, कैल्शियम साइनामाइड से आदि लेकिन महत्वपूर्ण यह दोनों ही हैं।
अमोनिया के भौतिक गुण
- अमोनिया रंगहीन एवं तीक्ष्ण गंध वाली गैस है।
- चूंकि यह जल के अणुओं के साथ हाइड्रोजन बंध बना लेती है इसलिए यह जल में अत्यधिक विलेय है।
- अमोनिया का क्रांतिक ताप 133°C होता है।
- अमोनिया वायु से हल्की है इसी कारण ही इसे प्रयोगशाला में वायु के अधोमुखी विस्थापन द्वारा एकत्र करते हैं।
अमोनिया के रासायनिक गुण
1. जल से अभिक्रिया
जल के साथ यह अमोनियम हाइड्रोक्साइड बनाती है।
NH3 + H2O \longrightarrow NH4OH
2. धातुओं से क्रिया
अमोनिया की धातु से क्रिया करने पर धातु एमाइड प्राप्त होते हैं।
2Na + 2NH3 \longrightarrow \scriptsize \begin{array}{rcl} 2NaNH_2 \\ सोडामाइड \end{array} + H2
3. क्लोरीन से क्रिया
क्लोरीन की अधिकता से सोडियम ट्राइक्लोराइड NCl3 बनता है जो कि एक विस्फोटक पदार्थ है।
NH3 + 3Cl2 \longrightarrow NCl3 + 3HCl
अमोनिया के उपयोग
- अमोनिया का उपयोग उर्वरकों के उत्पादन जैसे अमोनियम नाइट्रेट, यूरिया तथा अमोनियम सल्फेट आदि में किया जाता है।
- द्रव अमोनिया प्रशीतक के रूप में प्रयुक्त की जाती है।
- इसका उपयोग प्रयोगशाला में अभिकर्मक के रूप में किया जाता है।
- कृत्रिम रेशे, आंसू गैस तथा बर्फ आदि बनाने में प्रयोग की जाती है।
Nice
Iska Chitra V Iske bare mein 20 minut likhane Hain practical mein
Thanks you sir
Good
Aur thoda aasan bataiye
Sir Ammonia banane ki prayogshala vidhi chahie Sar mere ko
Very nice