डेनियल सेल
डेनियल सेल, गैल्वनी सेल का एक मुख्य उदाहरण है। डेनियल सेल बनाने के लिए जिंक (Zn) धातु की एक छड़ जिंक सल्फेट (ZnSO4) के विलयन में तथा कॉपर (Cu) धातु की एक छड़ कॉपर सल्फेट (CuSO4) के विलयन में रखकर दोनों विलयनों को लवण सेतु की सहायता से जोड़ दिया जाता है।
अतः इस प्रकार जिंक की छड़ एनोड का कार्य करती है तथा कॉपर की छड़ कैथोड का कार्य करती है। सेल के दो इलेक्ट्रॉडो के मध्य विभवों का अंतर सेल का विद्युत वाहक बल कहलाता है। तब
\footnotesize \boxed { E_{cell} = E_{कैथोड} - E_{एनोड} }
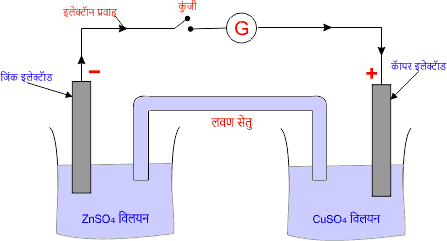
लवण सेतु
यह एक U आकार की कांच की एक नली होती है जिसमें KCl, KNO3, NH4Cl आदि विद्युत अपघट्य भरे होते हैं। लवण सेतु डेनियल सेल में एक महत्वपूर्ण भूमिका निभाता है। यह U आकार की होती है। परंतु उल्टी रखी जाती है या उल्टी प्रयोग की जाती है।
लवण सेतु के कार्य
लवण सेतु मुख्य रूप से दो कार्यों में संपन्न होता है
(1) लवण सेतु एक अर्ध सेल से दूसरे अर्ध सेल में आयनों के परिगमन को आसान करता है। अर्थात लवण सेतु दोनों अर्ध सेलों के विलयनों को संयोजित करता है जिससे इलेक्ट्रोड एक तार द्वारा आपस में संबंधित रहते हैं अतः इस प्रकार लवण सेतु परिपथ को पूर्ण करता है।
(2) लवण सेतु दोनों अर्ध सेलों के विलयनों की विद्युत उदासीनता को नियंत्रित करता है।
लवण सेतु के प्रयोग को समझने के लिए एक ऐसे सेल की परिकल्पना करते हैं जिसमें लवण सेतु विद्यमान नहीं है। डेनियल सेल से समझते हैं इस सेल में एनोड पर ऑक्सीकरण अभिक्रिया होती है जिसके फलस्वरुप जिंक परमाणु से Zn2+ आयन परिवर्तित हो जाते हैं। जो एनोड विलयन पर एकत्रित होते रहते हैं। तथा कैथोड पर अपचयन की प्रक्रिया होती है जिसके कारण CuSO4 विलयन से Cu2+ आयन परमाणु में अपचयित होकर कैथोड पर जमा होते रहते हैं।
अतः इस प्रकार ZnSO4 विलयन में धन आवेश की अधिकता हो जाती है एवं CuSO4 विलयन पर ऋण आवेश की अधिकता हो जाती है। इस प्रकार काॅपर की छड़ के चारों ओर ऋणावेश, काॅपर आयनों की ओर इलेक्ट्रॉनों का प्रवाह रोक देता है। जिसके कारण सेल कार्य करना बंद कर देता है। अतः लवण सेतु दोनों इलेक्ट्रोडों पर प्रयुक्त से अधिक आवेशों को एकत्रित नहीं होने देता है।
Ye bahut achha hai
Thanks sr
Thank you sir
Ye bahut accha hai