हाइड्रोजन स्पेक्ट्रम
हाइड्रोजन स्पेक्ट्रम की व्याख्या सबसे पहले बामर ने की थी। और बामर ने बताया कि हाइड्रोजन स्पेक्ट्रम में काली पृष्ठभूमि पर बहुत सी चमकीली रेखाएं होती है। जिन की चमक तथा उनके बीच की दूरी घटती जाती है। इस प्रकार यह रेखाएं एक श्रेणी का समूह बनाती हैं। जिसे बामर श्रेणी कहते हैं।
हाइड्रोजन स्पेक्ट्रम की श्रेणियां
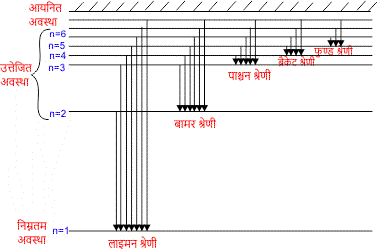
- लाइमन श्रेणी :-
जब किसी परमाणु में इलेक्ट्रॉन किसी उच्च ऊर्जा स्तर से प्रथम (निम्नतम) ऊर्जा स्तर में आता है। (अर्थात् n = 1) तो उत्सर्जित स्पेक्ट्रम की रेखाएं पराबैगनी भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्ध्य निम्न सूत्र द्वारा व्यक्त की जा सकती है।
\frac{1}{λ} = R[\frac{1}{1^2} - \frac{1}{n^2} (n = 2, 3, 4…∞)
इस श्रेणी की सबसे बड़ी तरंगदैर्ध्य (n = 2 के लिए) 1216 तथा सबसे छोटी तरंगदैर्ध्य (n = ∞ के लिए) 912 प्राप्त होती है। - बामर श्रेणी :-
जब किसी परमाणु में इलेक्ट्रॉन किसी उच्च ऊर्जा स्तर से दूसरे ऊर्जा स्तर में आता है। (अर्थात् n = 2) तो उत्सर्जित स्पेक्ट्रम की रेखाएं दृश्य भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्ध्य निम्न सूत्र द्वारा व्यक्त की जा सकती है।
\frac{1}{λ} = R[\frac{1}{2^2} - \frac{1}{n^2} (n = 3, 4, 5…∞)
इस श्रेणी की सबसे बड़ी तरंगदैर्ध्य (n = 3 के लिए) 6563 तथा सबसे छोटी तरंगदैर्ध्य (n = ∞ के लिए) 3646 प्राप्त होती है। - पाश्चन श्रेणी :-
जब किसी परमाणु में इलेक्ट्रॉन किसी उच्च ऊर्जा स्तर से तीसरे ऊर्जा स्तर में आता है। (अर्थात् n = 3) तो उत्सर्जित स्पेक्ट्रम की रेखाएं अवरक्त भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्ध्य निम्न सूत्र द्वारा व्यक्त की जा सकती है।
\frac{1}{λ} = R[\frac{1}{3^2} - \frac{1}{n^2} (n = 4, 5, 6…∞)
इस श्रेणी की सबसे बड़ी तरंगदैर्ध्य (n = 4 के लिए) 18735 तथा सबसे छोटी तरंगदैर्ध्य (n = ∞ के लिए) 8196 प्राप्त होती है। - ब्रैकेट श्रेणी :-
जब किसी परमाणु में इलेक्ट्रॉन किसी उच्च ऊर्जा स्तर से तीसरे ऊर्जा स्तर में आता है। (अर्थात् n = 4) तो उत्सर्जित स्पेक्ट्रम की रेखाएं अवरक्त भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्ध्य निम्न सूत्र द्वारा व्यक्त की जा सकती है।
\frac{1}{λ} = R[\frac{1}{4^2} - \frac{1}{n^2} (n = 5, 6, 7…∞)
इस श्रेणी की सबसे बड़ी तरंगदैर्ध्य (n = 5 के लिए) 40500 तथा सबसे छोटी तरंगदैर्ध्य (n = ∞ के लिए) 14516 प्राप्त होती है। - फुण्ड श्रेणी :-
जब किसी परमाणु में इलेक्ट्रॉन किसी उच्च ऊर्जा स्तर से तीसरे ऊर्जा स्तर में आता है। (अर्थात् n = 5) तो उत्सर्जित स्पेक्ट्रम की रेखाएं अवरक्त भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्ध्य निम्न सूत्र द्वारा व्यक्त की जा सकती है।
\frac{1}{λ} = R[\frac{1}{5^2} - \frac{1}{n^2} (n = 6, 7, 8…∞)
इस श्रेणी की सबसे बड़ी तरंगदैर्ध्य (n = 6 के लिए) 74580 तथा सबसे छोटी तरंगदैर्ध्य (n = ∞ के लिए) 22789 प्राप्त होती है।
पढ़ें… 12वीं भौतिकी नोट्स | class 12 physics notes in hindi pdf
Hi i am harsh class 12 thanks for this hydrogen spectrum