उपसहसंयोजक यौगिकों में समावयवता
जटिल यौगिक में समावयवता की विवेचना कीजिए? यह प्रश्न महत्वपूर्ण है। यह परीक्षाओं में भी कई बार पूछा जा चुका है।
जब दो या अधिक यौगिकों के रसायनिक सूत्र समान होते हैं परंतु इनके संरचना सूत्र भिन्न-भिन्न होते हैं। इन यौगिकों को समावयवी यौगिक कहते हैं। तथा इस प्रकार की घटना को समावयवता (isomerism in Hindi) कहते हैं।
समावयवता के प्रकार
उपसहसंयोजन यौगिकों में मुख्यतः दो प्रकार की समावयवता पायी जाती है।
1. त्रिविम समावयवता
2. संरचनात्मक समावयवता
1. त्रिविम समावयवता
जब दो या अधिक यौगिकों के रासायनिक सूत्र समान होते हैं। परंतु उनकी दिक् विन्यास व्यवस्थाएं भिन्न-भिन्न होती हैं। तो यह घटना त्रिविम समावयवता कहलाती है।
त्रिविम समावयवता निम्न प्रकार की होती हैं।
(a) ज्यामितीय समावयवता
(b) ध्रुवण (प्रकाशिक) समावयवता
(a) ज्यामितीय समावयवता
यह समावयवता केंद्रीय धातु आयन के चारों ओर लिगेंडो के विभिन्न ज्यामितीय वितरण के कारण उत्पन्न होती है यह दो प्रकार की होती है।
जब केंद्रीय धातु आयन के चारों ओर दो समान लिगेंड एक दूसरे के निकटवर्ती अर्थात् 90° पर होते हैं। तो उसे सिस समावयवी कहते हैं।
तथा जब केंद्रीय धातु आयन के चारों ओर दो लिगेंड विपरीत अर्थात् 180° पर होते हैं तो उसे ट्रांस समावयवी कहते हैं। चित्र से स्पष्ट है।

(b) ध्रुवण (प्रकाशिक) समावयवता
वह संकुल यौगिक जो एक दूसरे के दर्पण प्रतिबिंब होते हैं उन्हें एक दूसरे पर अध्यारोपित नहीं किया जा सकता है। इनका व्यवहार ध्रुवित प्रकाश के प्रति भिन्न होता है। ध्रुवण समावयवी कहलाते हैं। एवं यह घटना ध्रुवण समावयवता कहलाती है। इसे प्रकाशिक समावयवता भी कहते हैं।
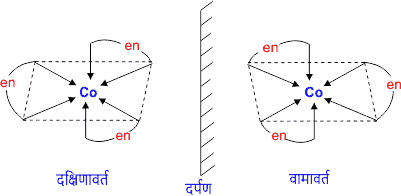
2. संरचनात्मक समावयवता
वह संकुल यौगिक जिनमें अणुसूत्र समान होते हैं परंतु इनके संरचना सूत्र भिन्न-भिन्न होते हैं। इस घटना को संरचनात्मक समावयवता कहते हैं।
संरचनात्मक समावयवता निम्न प्रकार की होती है।
(a) बंधनी समावयवता
(b) उपसहसंयोजन समावयवता
(c) आयनन समावयवता
(d) विलायकयोजन (हाइड्रेट) समावयवता
(a) बंधनी समावयवता
यह समावयवता संकुल यौगिकों में उभयदंती लिगेंड की उपस्थिति के कारण उत्पन्न होती है।
उदाहरण – [Cr(NH3)5(NO2)]Cl2 तथा [Co(NH3)5(ONO)]Cl2
(b) उपसहसंयोजन समावयवता
यह समावयवता धनात्मक तथा ऋणात्मक उपसहसंयोजन यौगिकों के मध्य लिगेंड के अंतः परिवर्तन के कारण उत्पन्न होती है।
उदाहरण – [Co(NH3)6][(Cr(CN)6] तथा [Co(CN)6][(Cr(NH3)6]
इसमें NH3 लिगेंड Co3+ से बंधित है एवं CN– लिगेंड Cr3+ से।
तथा दूसरे में NH3 लिगेंड Cr3+ से जुड़े हैं एवं CN– लिगेंड Co3+ से।
(c) आयनन समावयवता
इसको तो नाम से ही स्पष्ट होता है कि बेहद जटिल यौगिक जिनके रसायनिक सूत्र तो समान होते हैं परंतु यह बिलियन में भी नहीं देते हैं इन्हें आनंद समय पर वह भी कहते हैं एवं इस घटना को आयरन समावयवता कहते हैं।
उदाहरण – [Co(NH3)5Br]SO4 तथा [Co(NH3)5(SO4)]Br
(d) विलायकयोजन (हाइड्रेट) समावयवता
जब जल विलायक के रुप में प्रयुक्त होता है तो इस प्रकार की समावयवता को विलायकयोजन अथवा हाइड्रेट समावयवता कहते हैं।
उदाहरण – [Cr(H2O)6]Cl3 तथा [Cr(H2O)5Cl]Cl2H2O