नाइट्रिक अम्ल
नाइट्रिक अम्ल का निर्माण सर्वप्रथम वैज्ञानिक ग्लाॅबर ने शोर तथा सल्फ्यूरिक अम्ल के मिश्रण को गर्म करके किया था। जिस कारण ही नाइट्रिक अम्ल (nitric acid in Hindi) को शोरे का अम्ल भी कहते हैं।
नाइट्रिक अम्ल बनाने की विधि
वैसे तो नाइट्रिक अम्ल को कई विधियों द्वारा बनाया जा सकता है। लेकिन सबसे महत्वपूर्ण विधि ओस्टवाल्ड विधि है। यह वार्षिक परीक्षाओं में भी आ जाती है। इसके निर्माण की प्रयोगशाला विधि भी है।
1. प्रयोगशाला विधि
प्रयोगशाला में नाइट्रिक अम्ल का निर्माण कांच के रिटार्ट में सांद्र H2SO4 तथा NaNO3 अथवा KNO3 को गर्म करके किया जाता है।
NaNO3 + H2SO4 \longrightarrow NaHSO4 + \scriptsize \begin{array}{rcl} HNO_3 \\ नाइट्रिक\,अम्ल \end{array}
इस विधि से निम्न स्तर पर नाइट्रिक अम्ल बनाया जाता है औद्योगिक स्तर पर नाइट्रिक अम्ल ओस्टवाल्ड विधि द्वारा बनाया जाता है।
2. नाइट्रिक अम्ल बनाने की ओस्टवाल्ड विधि
औद्योगिक स्तर पर नाइट्रिक अम्ल, ओस्टवाल्ड विधि द्वारा बनायी जाती है। जिस कारण इसे नाइट्रिक अम्ल बनाने की औद्योगिक विधि भी कहते हैं।
इस विधि में शुद्ध अमोनिया तथा वायु के मिश्रण को उत्प्रेरक कक्ष में प्रवाहित करते हैं इस कक्ष में प्लेटिनम की जाली 800°C ताप पर गर्म होती है। जो उत्प्रेरक का कार्य करती है इसमें अमोनिया गैस नाइट्रिक ऑक्साइड NO में ऑक्सीकृत हो जाती है।
4NH3 + 5O2 \xrightarrow [800°C] {Pt} \scriptsize \begin{array}{rcl} 4NO \\ नाइट्रिक\,ऑक्साइड \end{array} + 6H2O
अब प्राप्त NO तथा वायु के मिश्रण को ऑक्सीकारक कक्ष (स्तंभ) में भेजा जाता है जहां NO का NO2 (नाइट्रोजन डाइऑक्साइड) में ऑक्सीकरण हो जाता है।
2NO + O2 \longrightarrow 2NO2
अब प्राप्त NO2 को क्वार्ट्ज (पत्थर के टुकड़ों) से भरे अवशोषण कक्ष में नीचे से प्रवेश कराते हैं जहां NO2 जल में अवशोषित होकर नाइट्रिक अम्ल बनाती है। चित्र से स्पष्ट है।
3NO2 + H2O \longrightarrow \scriptsize \begin{array}{rcl} 2HNO_3 \\ नाइट्रिक\,अम्ल \end{array} + NO
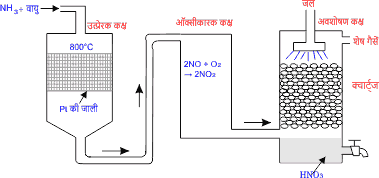
इस प्रकार तनु नाइट्रिक अम्ल प्राप्त होता है इस अम्ल का आसवन करके एक निश्चित क्वथनांक का मिश्रण प्राप्त होता है। जिसे सांद्र नाइट्रिक अम्ल कहते हैं।
नाइट्रिक अम्ल के भौतिक गुण
- नाइट्रिक अम्ल रंगहीन, गंधहीन द्रव है। इसका आपेक्षिक घनत्व 1.51 है।
- यह जल में पूर्ण रूप से विलेय है।
- त्वचा पर इसका प्रभाव अत्यंत घातक होता है। यह त्वचा पर फफोले डाल देती है।
नाइट्रिक अम्ल के रासायनिक गुण
1. अपघटन
यह सामान्य ताप पर प्रकाश की उपस्थिति में धीरे-धीरे अपघटित होकर भूरे रंग की गैस NO2 बनाता है।
4HNO3 \longrightarrow 4NO2 + O2 + 2H2O
2. अम्लीय प्रकृति
यह क्षारों के साथ क्रिया करके नाइट्रेट लवण बनाता है।
HNO3 + H2O \longrightarrow NO3– + H3O+
3. ऑक्सीकारक गुण
HNO3 एक प्रबल ऑक्सीकारक है चूंकि यह वियोजित होकर नवजात ऑक्सीजन देता है।
2HNO3 \longrightarrow H2O + 2NO2 + \scriptsize \begin{array}{rcl} [O] \\ नवजात\,ऑक्सीजन \end{array}
नाइट्रिक अम्ल के उपयोग
- नाइट्रिक अम्ल का प्रमुख उपयोग उर्वरकों जैसे – अमोनियम नाइट्रेट आदि में किया जाता है।
- प्रयोगशाला में अभिकर्मक के रूप में तथा अम्लराज बनाने में।
- विस्फोटक पदार्थ जैसे नाइट्रोग्लिसरीन, ट्राईनाइट्रो टाॅलूईन आदि में प्रयोग किया जाता है।
सधूम्र नाइट्रिक अम्ल
सांद्र नाइट्रिक अम्ल में नाइट्रोजन के ऑक्साइड (NO तथा NO2) खुले रहते हैं। सधूम्र नाइट्रिक अम्ल कहलाते हैं।
सधूम्र नाइट्रिक अम्ल में 98% HNO3 होता है जबकि शुद्ध नाइट्रिक अम्ल में 100% HNO3 होता है।
Thank you 🙏