रासायनिक अभिक्रियाएं एवं समीकरण कक्षा 10 विज्ञान का पहला अध्याय है। रासायनिक अभिक्रिया एवं समीकरण के प्रकार और अन्य टॉपिक के बारे में आइये अध्ययन करते हैं।
रासायनिक अभिक्रिया
जब एक या एक से अधिक पदार्थ परस्पर अभिक्रिया करके दूसरे नये पदार्थो का निर्माण करते हैं। तो इस प्रकार की अभिक्रिया को रासायनिक अभिक्रिया (chemical reaction in Hindi) कहते हैं।
वह पदार्थ जो रासायनिक अभिक्रिया में भाग लेते हैं। उन्हें अभिकारक कहते हैं। तथा जिन नए पदार्थों का रासायनिक अभिक्रिया में निर्माण होता होता है। उन्हें उत्पाद कहते हैं।

उदाहरण – जब मैग्नीशियम (Mg), हाइड्रोक्लोरिक अम्ल (HCl) से अभिक्रिया करती है तो मैग्नीशियम क्लोराइड तथा हाइड्रोजन गैस का निर्माण होता है।

रसायनिक समीकरण
रसायनिक अभिक्रिया, रसायनिक समीकरण द्वारा निरूपित की जाती है। रासायनिक समीकरण में अभिकारकों और उत्पादों के रसायनिक सूत्र उनकी भौतिक अवस्था के साथ लिखे जाते हैं।
\scriptsize \begin{array}{rcl} 2Mg\,+\,O_2 \\ अभिकारक \end{array} \longrightarrow \scriptsize \begin{array}{rcl} 2MgO \\ उत्पाद \end{array}
इस अभिक्रिया में मैग्नीशियम और ऑक्सीजन वे पदार्थ हैं। जिनमें रसायनिक परिवर्तन होता है। इन्हें अभिकारक कहा जाता है। तथा इस अभिक्रिया में मैग्नीशियम ऑक्साइड नए पदार्थ का निर्माण होता है। जिसे उत्पाद कहा जाता है।
रसायनिक समीकरण लिखना
रसायनिक समीकरण में अभिकारक बाएं ओर (LHS) लिखे जाते हैं तथा इनके बीच योग (+) चिन्ह लगाया जाता है। इसी प्रकार उत्पाद एक से अधिक होने पर इनके बीच चिन्ह (+) लगाकर दाएं ओर (RHS) लिखे जाते हैं। अभिकारकों और उत्पादों के बीच तीर (→) लगाया जाता है जिसकी दिशा उत्पाद की ओर रहती है।
रसायनिक अभिक्रिया को संतुलित करना
द्रव्यमान संक्षरण के नियमानुसार – किसी भी रसायनिक अभिक्रिया में द्रव्यमान का न ही निर्माण होता है और ना ही विनाश होता है अर्थात् अभिकारकों और उत्पादों का द्रव्यमान बराबर होता है।
रसायनिक अभिक्रिया के पहले तथा उसके पश्चात प्रत्येक तत्व के परमाणु की संख्या समान रहती है।
आइए निम्न रसायनिक अभिक्रिया को चरणबद्ध संतुलित करते हैं।
Fe + H2O \longrightarrow Fe3O4 + H2
चरण 1 → सबसे पहले रासायनिक समीकरण के प्रत्येक सूत्र के चारों और बॉक्स बना लीजिए। एवं समीकरण संतुलित करते समय इस बॉक्स के अंदर कुछ भी परिवर्तन नहीं किया जाता है।
\footnotesize \boxed { Fe } + \footnotesize \boxed { H_2O } \longrightarrow \footnotesize \boxed { Fe_3O_4 } + \footnotesize \boxed { H_2 }
चरण 2 → समीकरण में उपस्थित सभी तत्वों के परमाणु की संख्या की एक सूची बनाइए।
| तत्व | अभिकारकों में परमाणुओं की संख्या (LHS) | उत्पादों में परमाणुओं की संख्या (RHS) |
| Fe | 1 | 3 |
| H | 2 | 2 |
| O | 1 | 4 |
चरण 3 → सबसे पहले सबसे अधिक परमाणु वाले यौगिक को सन्तुलित कीजिए। चाहे वह अभिकारक हो या उत्पाद। उस यौगिक में सबसे अधिक परमाणु वाले तत्व को अनुचित गुणांक लगाकर सन्तुलित कीजिए।
जैसे – प्रस्तुत समीकरण में Fe3O4 के ऑक्सीजन के चार परमाणु हैं। जबकि बाएं ओर के ऑक्सीजन के केवल एक परमाणु है। अतः बाएं ओर 4 गुणांक लगाते हैं।
\footnotesize \boxed { Fe } + 4 \footnotesize \boxed { H_2O } \longrightarrow \footnotesize \boxed { Fe_3O_4 } + \footnotesize \boxed { H_2 }
Note – परमाणुओं की संख्या को बराबर करने के लिए हम यौगिक तथा तत्वों के सूत्रों को नहीं बदल सकते हैं। जैसे – 4 गुणांक लगाकर 4H4O बना है। इसे हम H2O4 या [H2O]4 नहीं बना सकते हैं।
चरण 4 → बाकी बचे सभी तत्वों के परमाणु व को चरण 3 की भांति सन्तुलित कीजिए।
जैसे – दाएं ओर के हाइड्रोजन के 8 परमाणु हैं। जबकि बाएं ओर 2 अतः बाएं ओर 4 गुणांक लगाकर हाइड्रोजन को सन्तुलित कीजिए। इसी प्रकार Fe के दाएं ओर 3 परमाणु हैं अतः बाएं ओर 3 गुणांक लगाइए।
3 \footnotesize \boxed { Fe } + 4 \footnotesize \boxed { H_2O } \longrightarrow \footnotesize \boxed { Fe_3O_4 } + 4 \footnotesize \boxed { H_2 }
चरण 5 → इस सन्तुलित समीकरण की जांच करने के लिए हम दोनों ओर के तत्वों के परमाणुओं का परिकलन करते हैं।
3Fe + 4H2O \longrightarrow Fe3O4 + 4H2
सभी तत्वों के परमाणुओं की संख्या दोनों ओर समान है। रसायनिक अभिक्रिया को सन्तुलित करने की इस विधि को हिट एंड ट्रायल विधि कहते हैं।
चरण 6 → अभिकारकों तथा उत्पादों की भौतिक अवस्था में लिखने का तरीका –
ठोस — (s)
द्रव — (ℓ)
गैस — (g)
जलीय विलियन — (aq)
3Fe (s) + 4H2O (g) \longrightarrow Fe3O4 (s) + 4H2 (g)
कुछ आवश्यक परिस्थितियां जैसे – ताप, दाब, उत्प्रेरक आदि को भी तीर के निशान के ऊपर या नीचे दर्शाया जाता है।
पढ़ें… अम्ल क्षार एवं लवण नोट्स | Class 10 science chapter 2 notes in Hindi
रसायनिक अभिक्रिया के प्रकार
कक्षा 10 के अंतर्गत रसायनिक अभिक्रिया के निम्न प्रकार हैं।
1. संयोजन अभिक्रिया
वह रासायनिक अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर केवल एक ही प्रकार के उत्पाद का निर्माण करते हैं। उसे संयोजन अभिक्रिया कहते हैं।
उदाहरण – (i) कोयले का दहन
C (s) + O2 (g) \longrightarrow CO2 (s)
(ii) जल का निर्माण
2H2 (g) + O2 (g) \longrightarrow 2H2O (ℓ)
(iii) सोडियम धातु, क्लोरीन में जलकर सोडियम क्लोराइड (NaCl) बनाती है।
2Na + Cl2 \longrightarrow 2NaCl
Note – वह रसायनिक अभिक्रियाएं जिनमें उत्पाद के निर्माण के साथ-साथ ऊष्मा का भी उत्सर्जन होता है उसे ऊष्माक्षेपी रसायनिक अभिक्रिया कहते हैं।
जैसे – प्राकृतिक गैस का दहन
CH4 (g) + 2O2 (g) \longrightarrow CO2 (g) + 2H2O (g) + ऊष्मा
2. वियोजन अभिक्रिया
वह रसायनिक अभिक्रिया जिसमे एकल अभिकारक टूट कर दो या दो से अधिक उत्पाद का निर्माण करते हैं। तो उसे वियोजन अभिक्रिया कहते हैं। यह अभिक्रिया ऊष्मा तथा प्रकाश अथवा विद्युत द्वारा संपन्न होती है।
वियोजन अभिक्रिया दो प्रकार की होती है।
(a) उष्मीय वियोजन – ऊष्मा के द्वारा की गई वियोजन अभिक्रिया को उष्मीय वियोजन कहते हैं।
उदाहरण –
(i) \scriptsize \begin{array}{rcl} CaCO_3\, (s) \\ कैल्शियम\,कार्बोनेट \end{array} \xrightarrow {ऊष्मा} \scriptsize \begin{array}{rcl} CaO\,(s) \\ कैल्शियम\,ऑक्साइड \end{array} + \scriptsize \begin{array}{rcl} CO_2\,(g) \\ कार्बन\,डाइऑक्साइड \end{array}
(ii) \scriptsize \begin{array}{rcl} 2HgO \\ मरकरी\,ऑक्साइड \end{array} \xrightarrow {ऊष्मा} \scriptsize \begin{array}{rcl} 2Hg \\ मरकरी \end{array} + \scriptsize \begin{array}{rcl} O_2 \\ ऑक्सीजन \end{array}
(b) विद्युत वियोजन – विद्युत धारा के द्वारा की गई वियोजन अभिक्रिया को विद्युत वियोजन कहते हैं।
उदाहरण –
\scriptsize \begin{array}{rcl} 2H_2O\, (l) \\ जल \end{array} \xrightarrow {विद्युत\,धारा} \scriptsize \begin{array}{rcl} 2H_2\,(g) \\ हाइड्रोजन \end{array} + \scriptsize \begin{array}{rcl} O_2\,(g) \\ ऑक्सीजन \end{array}
Note – जिन रसायनिक अभिक्रियाओं में ऊर्जा अवशोषित होती है। उन्हें ऊष्माशोषी अभिक्रिया कहते हैं। जैसे –
N2 + O2 \longrightarrow 2NO – ऊष्मा
3. विस्थापन अभिक्रिया
वह रासायनिक अभिक्रियाएं जिसमें अधिक क्रियाशील तत्व कम क्रियाशील तत्वों को उसके यौगिक से विस्थापित कर देते हैं। तो उसे विस्थापन अभिक्रिया कहते हैं।
उदाहरण –
(i) आयरन (Fe), कॉपर सल्फेट (CuSO4) विलयन से कॉपर को विस्थापित कर देता है। तथा फेरस सल्फेट व कॉपर बनते हैं।
Fe (s) + \scriptsize \begin{array}{rcl} CuSO_4\, (aq) \\ कॉपर\,सल्फेट \end{array} \longrightarrow \scriptsize \begin{array}{rcl} FeSO_4\,(aq) \\ फेरस\,सल्फेट \end{array} + Cu (s)
(ii) लेड, कॉपर की अपेक्षा अधिक क्रियाशील है। ये कॉपर को उसके यौगिक से विस्थापित कर देता है।
Pb (s) + \scriptsize \begin{array}{rcl} CuCl_2\, (aq) \\ कॉपर\,क्लोराइड \end{array} \longrightarrow \scriptsize \begin{array}{rcl} PbCl_2\,(aq) \\ लेड\,क्लोराइड \end{array} + Cu (s)
4. द्विविस्थापन अभिक्रिया
वह अभिक्रियाएं जिनमें उत्पादों का निर्माण, दो यौगिकों के बीच आयनों के आदान-प्रदान से होता है। तो उसे द्विविस्थापन अभिक्रिया कहते हैं।
उदाहरण –

बेरियम सल्फेट से श्वेत अविलेय अवक्षेप का निर्माण होता है। इसलिए इस अभिक्रिया को अवक्षेपण अभिक्रिया कहते हैं।
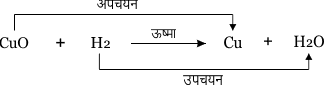
5. उपचयन अपचयन
जब किसी पदार्थ में ऑक्सीजन की वृद्धि होती है। तो उसे उपचयन कहते हैं।
जब किसी पदार्थ में ऑक्सीजन का ह्रास होता है तो उसे अपचयन कहते हैं।
वह रसायनिक अभिक्रिया जिसमे एक अभिकारक उपचयित तथा दूसरा अभिकारक अपचयित होता है। तो इन अभिक्रियाओं को उपचयन-अपचयन या रेडॉक्स अभिक्रिया कहते हैं।
पढ़ें… कक्षा 10 विज्ञान नोट्स | class 10 science notes in Hindi PDF download NCERT 2024
दैनिक जीवन में उपचयन के प्रभाव
1. संक्षारण
जब कोई धातु अपने आसपास अम्ल आर्द्रता आदि के संपर्क में आती है तो यह संचारित हो जाती है इस अभिक्रिया को संक्षारण कहते हैं।
लोहे की वस्तुओं पर जंग लगना चांदी के ऊपर काली परत तथा तांबे के ऊपरी परत का चढ़ना संक्षारण के उदाहरण हैं लोहे का संक्षारण एक गंभीर समस्या है।
2. विकृतगंधिता
जब वसायुक्त और तैलीय खाद्य सामग्री वायु के संपर्क में आने पर ऑक्सीजन से क्रिया करके उपचयित हो जाती है। जिससे उनके स्वाद और गंध में परिवर्तन हो जाता है। इस प्रक्रिया को विकृतगंधिता कहते हैं।
अचार और मुरब्बे का वायु में रखने पर खराब हो जाना विकृतगंधिता का उदाहरण है।
खाद्य पदार्थों में प्रतिऑक्सीकारक मिलाकर तथा वायुरोधी बर्तनों में खाद्य सामग्री को रखकर विकृतगंधिता होने से बचाया जा सकता है।
रासायनिक अभिक्रियाएं एवं समीकरण नोट्स PDF
इस लेख के अंतर्गत हमने रासायनिक अभिक्रियाएं एवं समीकरण पाठ का पूर्ण अध्ययन किया है। यह science class 10 का chapter 1 है। इसके अंदर कई महत्वपूर्ण टॉपिक हैं। जिनकी परिभाषा एवं उदाहरण प्रस्तुत किए गए हैं। तथा रासायनिक अभिक्रिया एवं समीकरण PDF का कार्य तत्पर है। जैसे ही PDF तैयार हो जाएगी। तब उसका download बटन लगा दिया जाएगा।
Chemical reactions and equations in Hindi
Chemical reactions की परिभाषा और प्रकार के बारे में हम ऊपर पढ़ चुके हैं। रसायनिक अभिक्रिया एवं समीकरण का पूर्ण अध्ययन इसी लेख में किया गया है। इसे ध्यान से पढ़ें और लिखकर अभ्यास करें, एवं अपने विचारों को कमेंट से हमें जरूर बताएं।
रासायनिक अभिक्रिया एवं समीकरण प्रश्न उत्तर
Q.1 रसायनिक अभिक्रिया किसे कहते हैं?
Ans. जब एक या एक से अधिक पदार्थ परस्पर अभिक्रिया करके दूसरे नये पदार्थो का निर्माण करते हैं। तो इस प्रकार की अभिक्रिया को रासायनिक अभिक्रिया कहते हैं।
Q.2 संयोजन अभिक्रिया का उदाहरण दीजिए?
Ans. C (s) + O2 (g) → CO2 (s)
Q.3 विस्थापन अभिक्रिया को परिभाषित कीजिए?
Ans. वह रासायनिक अभिक्रियाएं जिसमें अधिक क्रियाशील तत्व कम क्रियाशील तत्वों को उसके यौगिक से विस्थापित कर देते हैं। तो उसे विस्थापन अभिक्रिया कहते हैं।