संतृप्त एवं असंतृप्त कार्बनिक यौगिक
कार्बन परमाणु एक दूसरे से एकल, द्वि या त्रिक आबंध द्वारा जुड़े हो सकते हैं।
कार्बन परमाणुओं के बीच केवल एकल आबंध से जुड़े कार्बन के यौगिकों को संतृप्त कार्बनिक यौगिक कहते हैं। जबकि द्वि या त्रिक-आबंध से जुड़े कार्बन के यौगिकों को असंतृप्त कार्बनिक यौगिक कहते हैं।
कार्बन और हाइड्रोजन के संयोग से बनने वाले कार्बनिक यौगिक को हाइड्रोकार्बन कहते हैं। जैसे – CH4, C2H6, C2H4, C2H2 आदि।
हाइड्रोकार्बन दो प्रकार के होते हैं।
1. संतृप्त हाइड्रोकार्बन
2. असंतृप्त हाइड्रोकार्बन
Note – संतृप्त एवं असंतृप्त कार्बनिक यौगिक को हाइड्रोकार्बन भी लिख सकते हैं। कहीं-कहीं हाइड्रोकार्बन तो कहीं-कहीं कार्बनिक यौगिक का प्रयोग किया गया है।
1. संतृप्त हाइड्रोकार्बन
वह हाइड्रोकार्बन जिनके अणुओं में उपस्थित कार्बन परमाणुओं के बीच एकल आबंध होता है। उन्हें संतृप्त हाइड्रोकार्बन कहते हैं। इनका सामान्य सूत्र CnH2n+2 होता है उदाहरण – मेथेन CH4, एथेन C2H6, प्रोपेन C3H8 आदि।
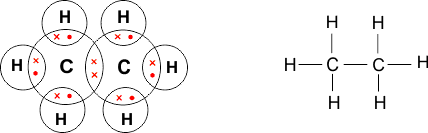
कार्बन परमाणु सहसंयोजी आबंध द्वारा जुड़ जाते हैं। लेकिन प्रत्येक कार्बन परमाणु की तीन संयोजकता असंतुष्ट रहती हैं। अतः प्रत्येक कार्बन परमाणु तीन हाइड्रोजन परमाणुओं के साथ आबंध किया जाता है। जिससे कार्बन परमाणु की चारों संयोजकता संतुष्ट हो जाती हैं।
| कार्बन परमाणु की संख्या | हाइड्रोकार्बन का नाम | आणविक सूत्र | संरचना सूत्र |
| 1 | मेथेन | CH4 |  |
| 2 | एथेन | C2H6 |  |
| 3 | प्रोपेन | C3H8 | 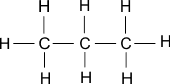 |
| 4 | ब्यूटेन | C4H10 |  |
| 5 | पेंटेन | C5H12 |  |
इस श्रेणी के यौगिकों को एल्केन या पैराफिन कहा जाता है। यह कम क्रियाशील होते हैं। परंतु प्रतिस्थापित यौगिक का निर्माण करते हैं।
2. असंतृप्त हाइड्रोकार्बन
वह हाइड्रोकार्बन जिनके अणुओं में उपस्थित कार्बन परमाणुओं के बीच द्वि या त्रिक-आबंध होता है। उन्हें असंतृप्त हाइड्रोकार्बन कहते हैं।
जिन कार्बन परमाणुओं के बीच द्वि-आबंध होता है। उन्हें एथीन या एल्कीन कहते हैं। इनको सामान्य सूत्र CnH2n होता है। तथा जिन कार्बन परमाणुओं के बीच त्रिक-आबंध होता है उन्हें एथाइन या एल्काइन कहते हैं। इनका सामान्य सूत्र CnH2n-2 होता है।
उदाहरण – एथिलीन, प्रोपिलीन, एसिटिलीन आदि।

एथीन और एथाइन का इलेक्ट्रॉन बिंदु संरचना को चित्र में प्रदर्शित किया गया है। एथीन में कार्बन परमाणुओं की संयोजकता को संतुष्ट करने के लिए दो कार्बन परमाणुओं के बीच द्वि-आबंध होता है। तथा एथाइन में त्रिक-आबंध होता है। असंतृप्त हाइड्रोकार्बन, संतृप्त हाइड्रोकार्बन की तुलना में अधिक क्रियाशील होते हैं।
| हाइड्रोकार्बन के नाम | आणविक सूत्र | संरचना सूत्र |
| एथीन | C2H4 | 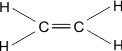 |
| प्रोपीन | C3H6 | 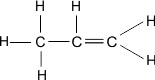 |
| एथाइन | C2H2 | |
| प्रोपाइन | C3H4 |  |
संतृप्त और असंतृप्त हाइड्रोकार्बन में अंतर
| क्रम संख्या | संतृप्त हाइड्रोकार्बन | असंतृप्त हाइड्रोकार्बन |
| 1 | संतृप्त हाइड्रोकार्बन कम क्रियाशील होते हैं। | असंतृप्त हाइड्रोकार्बन अधिक क्रियाशील होते हैं। |
| 2 | संतृप्त हाइड्रोकार्बन प्रतिस्थापित यौगिक का निर्माण करते हैं। | असंतृप्त हाइड्रोकार्बन शीघ्र ही योगशील यौगिक का निर्माण करते हैं। |
| 3 | संतृप्त हाइड्रोकार्बन ब्रोमीन जल का रंग नहीं उड़ाते हैं। | असंतृप्त हाइड्रोकार्बन ब्रोमीन जल का रंग उड़ा देते हैं। |