तत्वों को उनके गुणधर्मों के आधार पर धातु एवं अधातु में वर्गीकृत किया जाता है। धातु एवं अधातु कक्षा 10 विज्ञान का तीसरा पाठ है। इस पाठ में कई महत्वपूर्ण टॉपिक हैं। आइये उनका अध्ययन करते हैं।
धातु एवं अधातु नोट्स
धातुओं को धन-विद्युती तत्व भी कहते हैं। जैसे- सोना, चांदी, तांबा, पारा, प्लैटिनम, पोटैशियम, सोडियम आदि।
अधातु को ऋण-विद्युती तत्व कहते हैं। जैसे– कार्बन, ऑक्सीजन, नाइट्रोजन, फास्फोरस आदि। तत्वों में लगभग 80% तत्व धातु है एवं 20% तत्व धातु है।

धातु के भौतिक गुणधर्म
- इनमें धात्विक चमक होती है अर्थात् शुद्ध रूप में धातु की सतह चमकदार होती है।
- धातुएं सामान्यतः कठोर होती हैं प्रत्येक धातु की कठोरता अलग-अलग होती है।
- धातुएं आघातवर्ध्यता होती हैं अर्थात् इन्हें पीटकर पतली चादर के रूप में बनाया जा सकता है।
- धातुओं को पतले तार के रूप में खींचा जा सकता है जिसे तन्यता कहते हैं।
- धातुएं ऊष्मा एवं विद्युत की सुचालक होती हैं।
- धातुओं के घनत्व एवं गलनांक बहुत अधिक होते हैं। (सोडियम और पोटैशियम को छोड़कर)।
- धातुएं कमरे के ताप पर ठोस रूप में पाई जाती हैं। पारे को छोड़कर जो द्रव रूप में पाया जाता है।
पढ़ें… कार्बन एवं उसके यौगिक नोट्स | class 10 science chapter 4 notes in Hindi pdf
पढ़ें… अम्ल क्षार एवं लवण नोट्स | Class 10 science chapter 2 notes in Hindi
धातुओं के भौतिक गुणधर्म
- अधातु में कोई विशेष चमक नहीं होती है। लेकिन आयोडीन अधातु होते हुए भी चमकीला होता है।
- अधातु में अधिकतर कठोर नहीं होती हैं कार्बन का अपरूप हीरा सबसे कठोर प्राकृतिक पदार्थ है।
- अधातुएं आघातवर्ध्यता नहीं होती हैं।
- अधातुओं में तन्यता गुण भी नहीं होता है।
- ग्रेफाइट के अतिरिक्त अधातु ऊष्मा एवं विद्युत की कुचालक होती हैं।
- अधातु का घनत्व एवं गलनांक प्रायः कम होता है।
- अधातुएं कमरे के ताप पर ठोस या गैस रूप में पाई जाती हैं। ब्रोमीन को छोड़कर जो द्रव रूप में होती है।
Note – अगर परीक्षा में धातु एवं अधातु में अंतर आता है। तो आप इन गुणों को ही एक टेबल बनाकर कर देना।
धातुओं के रासायनिक गुण
1. वायु के साथ अभिक्रिया – लगभग सभी धातुएं ऑक्सीजन के साथ अभिक्रिया करके धातु ऑक्साइड बनती हैं।
धातु + ऑक्सीजन \longrightarrow धातु ऑक्साइड
2Cu + O2 \longrightarrow 2CuO
4Al + 3O2 \longrightarrow 2Al2O3
2. जल के साथ अभिक्रिया – धातुओं के ऑक्साइड क्षारीय होते हैं यह जल में घुलकर क्षार बनाते हैं।
MgO + H2O \longrightarrow Mg(OH)2
3. तनु अम्लों के साथ अभिक्रिया – अधिकांश धातुएं तनु HCl या H2SO4 के साथ अभिक्रिया करके हाइड्रोजन गैस विस्थापित करती हैं।
धातु + तनु अम्ल \longrightarrow लवण+ हाइड्रोजन
Fe + 2HCl \longrightarrow FeCl2 + H2
Mg + H2SO4 \longrightarrow MgSO4 + H2
4. धातुओं की धातुओं के साथ अभिक्रिया – तत्वों की अभिक्रियाशीलता संयोजकता कोश को पूर्ण करने की प्रवृत्ति के रूप में समझी जा सकती है।
धातुओं के परमाणु अपने संयोजकता कोश से इलेक्ट्रॉन का त्याग करके धनायन बनाते हैं। तथा अधातु के परमाणु संयोजकता कोश में इलेक्ट्रॉन ग्रहण करके ऋणायन बनाते हैं।
उदाहरण – NaCl का निर्माण
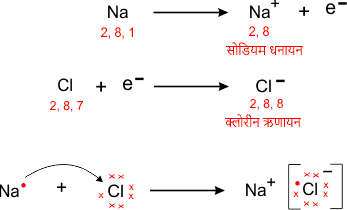
उभयधर्मी ऑक्साइड
वे धातु ऑक्साइड जो अम्ल और क्षार दोनों के साथ अभिक्रिया करते हैं। तथा लवण एवं जल उत्पन्न करते हैं। उभयधर्मी ऑक्साइड कहलाते हैं।
जैसे – ऐल्युमिनियम ऑक्साइड Al2O3 तथा जिंक ऑक्साइड ZnO आदि।
Al2O3 + 6HCl \longrightarrow 2AlCl3 + 3H2O
Al2O3 + 2NaOH \longrightarrow 2NaAlO2 + H2O
सक्रियता श्रेणी
वह सूची जिसमें धातुओं को अभिक्रियाशीलता के आधार पर अवरोही क्रम में व्यवस्थित किया जाता है। तब एक श्रेणी प्राप्त होती है। जिसे सक्रियता श्रेणी कहते हैं।
| K | पोटैशियम | सबसे अधिक अभिक्रियाशीलता |
| Na | सोडियम | |
| Ca | कैल्शियम | |
| Mg | मैग्नीशियम | |
| Al | ऐल्युमिनियम | |
| Zn | जिंक | |
| Fe | आयरन | 🠋 घटती अभिक्रियाशीलता |
| Pb | लेड | |
| He | हाइड्रोजन | |
| Cu | कॉपर (तांबा) | |
| Hg | मर्करी (पारा) | |
| Ag | सिल्वर | |
| Au | गोल्ड | सबसे कम अभिक्रियाशीलता |
पढ़ें… कक्षा 10 विज्ञान नोट्स | class 10 science notes in Hindi PDF download NCERT 2024
आयनिक यौगिक
किसी परमाणु से किसी दूसरे परमाणु पर इलेक्ट्रॉनों के स्थानांतरण से बनने वाले आयनिक बंध युक्त यौगिकों को आयनिक यौगिक कहा जाता है। आयनिक बंध धातु और अधातु के बीच बनते हैं।
आयनिक यौगिक के गुण
- आयनिक यौगिक ठोस व कुछ कठोर होते हैं ये यौगिक सामान्यतः भंगुर होते हैं।
- आयनिक यौगिकों के गलनांक व क्वथनांक बहुत अधिक होते हैं।
- आयनिक यौगिक प्रायः जल में घुलनशील हैं।तथा कैरोसिन, पेट्रोल आदि जैसे विलायकों में घुलनशील नहीं है।
- आयनिक यौगिक जलीय विलयन और गलित अवस्था में विद्युत के सुचालक हैं। तथा ठोस अवस्था में विद्युत का कुचालक हैं।
धातुओं की प्राप्ति
खनिज – पृथ्वी में प्राकृतिक रूप में उपस्थित तत्वों एवं यौगिकों को खनिज कहते हैं।
अयस्क – वह खनिज जिनमें धातु प्रचुर मात्रा में पाई जाती हैं। जिसे कम व्यय पर आसानी से निकाला जा सकता है। उसे अयस्क कहते हैं।
सभी अयस्क खनिज होते हैं परंतु सभी खनिज अयस्क नहीं होते हैं।

कुछ प्रमुख परिभाषाएं
(i) गैंग – पृथ्वी से प्राप्त खनिज अयस्कों में रेत, मिट्टी आदि कई प्रकार की अशुद्धियां पाई जाती हैं। जिन्हें गैंग कहते हैं।
(ii) भर्जन – सल्फाइड अयस्क को वायु की उपस्थिति में उच्च ताप पर गर्म करने पर यह ऑक्साइड में बदल जाता है। इस प्रक्रिया को भजन कहते हैं।
2ZnS + 3O2 \xrightarrow {ताप} 2ZnO + 2SO2
(iii) निस्तापन – कार्बोनेट अयस्क को सीमित वायु में उच्च ताप पर गर्म करने पर यह ऑक्साइड में बदल जाता है। इस प्रक्रिया को निस्तापन कहते हैं।
ZnCO3 \xrightarrow {ताप} ZnO + CO2
(iv) अपचयन – धातु ऑक्साइड से कार्बन जैसे अपचायक का उपयोग करके धातु प्राप्त की जा सकती है। जैसे –
ZnO + C \longrightarrow Zn + CO
संक्षारण
धातु अपने आसपास उपस्थित अम्ल, आर्द्रता तथा वायु के संपर्क में आने पर संक्षारित हो जाती है। जैसे –
(a) सिल्वर – सिल्वर वायु में उपस्थित सल्फर के साथ अभिक्रिया करके सिल्वर सल्फाइड की परत बनती है। जिस कारण सिल्वर से बनी वस्तु काली हो जाती हैं।
(b) कॉपर – कॉपर वायु में उपस्थित आर्द्र कार्बन डाइऑक्साइड के साथ क्रिया करके हरे रंग का कॉपर कार्बोनेट बनाता है।
(c) लोहा – लंबे समय तक आर्द्र वायु में रहने पर लोहे पर भूरे रंग की परत चढ़ जाती है जिसे जंग कहते हैं। जो लोहे को धीरे-धीरे क्षतिग्रस्त करती रहती है।
संक्षारण रोकने के उपाय
लोहे को जंग लगने से निम्न प्रकार बचाया जा सकता है।
पेंट करके, तेल लगाकर, ग्रीस लगाकर, लोहे की वस्तुओं पर जस्ते की परत चढ़ाकर, क्रोमियम लेपन से, एनोडीकरण या मिश्रधातु बनाकर बचाया जा सकता है।
Note – लोहे एवं इस्पात को जंग से बचने के लिए इस पर जस्ते की परत चढ़ाई जाती है। इस प्रक्रम को यशदलेपन कहते हैं।
मिश्रधातु
दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्रधातु कहते हैं। मिश्र धातु के भौतिक गुण मूल धातु के गुण से भिन्न होते हैं। कुछ महत्वपूर्ण मिश्रधातु को नीचे दर्शाया गया है।
पीतल = कॉपर + जिंक
कांसा = कॉपर + टिन
सोल्डर = लेड + टिन
अमलगम = मर्करी + अन्य तत्व
Class 10 Science chapter 3 notes in Hindi PDF
धातु एवं अधातु कक्षा 10 का तीसरा पाठ है। इस पाठ में जितने भी महत्वपूर्ण टॉपिक हैं। लगभग उन सभी पर Study Nagar द्वारा आसान भाषा में परिभाषाएं दी गई हैं। जिनको उदाहरण द्वारा अच्छे से समझाया गया है।
अगर इसके अंतर्गत आपको कहीं कोई कमी या आपका कोई सुझाव है। तो हमें कमेंट या ईमेल के माध्यम से जरूर बताएं। हम जल्द से जल्द आपकी समस्या का समाधान करने का प्रयास करेंगे