कार्बन एवं उसके यौगिक नोट्स
कार्बन एक अधातु है जिसका प्रतीत ‘C’ होता है। यह आवर्त सारणी के p-ब्लॉक के वर्ग 14 का प्रथम सदस्य है। कार्बन का परमाणु क्रमांक 6 तथा परमाणु भार 12 होता है।
सर्वतोमुखी तत्व कार्बन भूपर्पटी में खनिजों के रूप में 0.02% तथा वायुमंडल में कार्बन डाइऑक्साइड के रूप में 0.03% पाया जाता है। कार्बन की चतु: संयोजकता एवं श्रृंखलन प्रकृति के कारण यह अनेक यौगिक बनाता है।

कार्बन में सहसंयोजी आबंध
दो परमाणुओं के बीच अपने-अपने बाहरी कोश को पूर्ण करने के लिए इलेक्ट्रॉनों की साझेदारी से सहसंयोजी आबंध बनता है। कार्बन अपने तथा अन्य तत्वों जैसे – हाइड्रोजन, ऑक्सीजन, क्लोरीन, सल्फर तथा नाइट्रोजन के साथ सहसंयोजी आबंध बनाता है।
कार्बन के परमाणु में कुल 6 इलेक्ट्रॉन होते हैं। इसकी बाहरी कोश में 4 इलेक्ट्रॉन तथा भीतरी कोश में 2 इलेक्ट्रॉन होते हैं। अतः कार्बन को उत्कृष्ट गैस विन्यास को प्राप्त करने के लिए 4 इलेक्ट्रॉन ग्रहण या 4 इलेक्ट्रॉन का त्याग करने की आवश्यकता होती है। लेकिन यह करना मुश्किल हो सकता है। क्योंकि इसमें अत्यधिक ऊर्जा की आवश्यकता होगी।
कार्बन की 4 संयोजकता होती है। कार्बन के बाहरी कोश में उपलब्ध 4 इलेक्ट्रॉन 4 सहसंयोजी आबंध बनाने में प्रयुक्त होते हैं। सहसंयोजी आबंध एकल-बंध, द्वि-बंध तथा त्रिक-बंध के रूप में हो सकते हैं।
सहसंयोजी यौगिकों के उदाहरण
1. H2 का निर्माण –

Note – चूंकि यहां हाइड्रोजन परमाणुओं के बीच एक-एक इलेक्ट्रॉन की साझेदारी हुई है। इसलिए यहां हाइड्रोजन-हाइड्रोजन के बीच एकल-बंध है।
2. O2 का निर्माण –
O = 8 → 2, 6
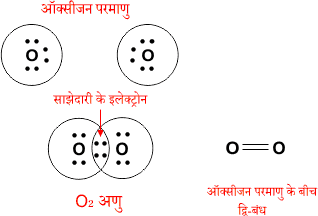
3. N2 का निर्माण –
N = 7 → 2, 5
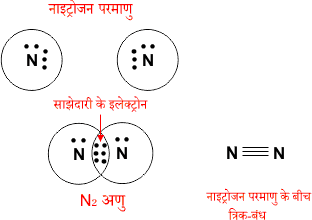
4. H2O का निर्माण –
H = 1
O = 8 → 2, 6

सहसंयोजी यौगिक के गुण
- सहसंयोजी यौगिक के गलनांक व क्वथनांक कम होते हैं।
- सहसंयोजी यौगिक विद्युत के कुचालक होते हैं।
- सहसंयोजी यौगिक अणुओं के बने होते हैं।
- सहसंयोजी यौगिक जल में अविलेय होते हैं।
पढ़ें… धातु एवं अधातु नोट्स | Class 10 Science chapter 3 notes in Hindi PDF
पढ़ें… जैव प्रक्रम नोट्स | class 10 science chapter 5 notes in Hindi
कार्बनिक यौगिकों की नाम पद्धति
वर्तमान समय में कार्बनिक यौगिकों के नामकरण की दो पद्धति हैं।
1. निरर्थक पद्धति
2. IUPAC या जिनेवा पद्धति
आईयूपीएसी नाम पद्धति में कार्बनिक यौगिकों के नाम ऐसी ऐल्केनों के IUPAC नाम के आधार पर लिखे जाते हैं। जिनमें उपस्थित सभी कार्बन परमाणु एक ही सीधी श्रृंखला में होते हैं। ऐसी ऐल्केनों को संगत एल्केन कहते हैं। इनके नामकरण में अनुलग्न तथा पूर्वलग्न प्रयोग किए जाते हैं। जैसे – एल्कोहॉल के नाम हैं – मेथेनॉल, एथेनॉल तथा प्रोपेनॉल आदि।
Note – IUPAC नामकरण पर Study Nagar द्वारा एक स्पेशल लेख पहले ही लिखा जा चुका है। जिसमें इसके नियम व नामकरण के उदाहरण दिए गए हैं। लेकिन वह लेख कक्षा 11 के आधार पर है इसलिए आप छात्र वहां से अपने सिलेबस के आधार पर ही क्रियात्मक समूह का अध्ययन करें।
पढ़ें…कार्बनिक यौगिकों का नामकरण | IUPAC नामपद्धति के नियम, उदाहरण, संरचना सूत्र
| क्रम संख्या | क्रियात्मक समूह | अनुलग्न/पूर्वलग्न | सूत्र | उदाहरण |
| 1 | हैलोजन | क्लोरो, ब्रोमो आदि | —X | CH3Cl क्लोरोमेथेन |
| 2 | एल्कोहॉल | ऑल (ol) | —OH | C2H5OH एथेनॉल |
| 3 | एल्डिहाइड | एल (al) | —CHO | CH3CH2CHO प्रोपेनेल |
| 4 | कीटोन | ओन (one) | =CO | CH3COCH3 प्रोपेनोन |
| 5 | कार्बोक्सिलिक अम्ल | ओइक अम्ल (oic acid) | —COOH | CH3CH2COOH प्रोपेनोइक अम्ल |
| 6 | एल्कीन | ईन (ene) | CH3–HC=CH2 प्रोपीन | |
| 7 | एल्काइन | आइन (yne) | CH3–C≡CH प्रोपाइन |
कार्बनिक यौगिकों के रासायनिक गुण
1. दहन – कार्बन तथा उसके यौगिक ईंधन के रूप में प्रयोग किए जाते हैं। अधिकांश कार्बनिक यौगिक दहन पर प्रचुर मात्रा में ऊष्मा एवं प्रकाश मुक्त करते हैं। संतृप्त हाइड्रोकार्बन वायु की उपस्थिति में जलने पर नीली स्वच्छ ज्वाला उत्पन्न करते हैं। जबकि असंतृप्त हाइड्रोकार्बन से अत्यधिक काले धुएं वाली पीली ज्वाला निकलती है।
C + O2 \xrightarrow {दहन} CO2 + ऊष्मा + प्रकाश
CH4 + 2O2 \xrightarrow {दहन} CO2 + 2H2O + ऊष्मा + प्रकाश
2. ऑक्सीकरण – क्षारीय पोटैशियम परमैंगनेट (KmnO4) या अम्लीय पोटैशियम डाइक्रोमेट (K2Cr2O7) की उपस्थिति में एल्कोहॉल, कार्बोक्सिलिक अम्ल में परिवर्तित हो जाता है।
\scriptsize \begin{array}{rcl} CH_3CH_2OH \\ एथेनॉल \end{array} \xrightarrow [या\,अम्लीय\,K_2Cr_2O_7] {क्षारीय\,KmnO_4} \scriptsize \begin{array}{rcl} CH_3COOH \\ एथेनॉइक\,अम्ल \end{array}
छारीय पोटैशियम परमैंगनेट या अम्लीय पोटैशियम डाइक्रोमेट एल्कोहॉलों को अम्लों में ऑक्सीकृत करते हैं। अतः इन्हें ऑक्सीकारक कहा जाता है।
3. संकलन अभिक्रिया – पैलेडियम या निकेल उत्प्रेरक की उपस्थिति में असंतृप्त हाइड्रोकार्बन हाइड्रोजन जोड़कर संतृप्त हाइड्रोकार्बन का निर्माण करता है।
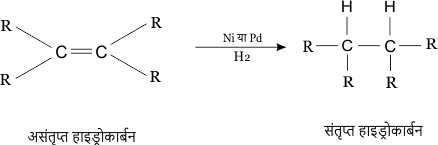
वनस्पति तेलों से वनस्पति घी का उत्पादन इसी विधि द्वारा होता है।
4. प्रतिस्थापन अभिक्रिया – सूर्य के प्रकाश की उपस्थिति में मेथेन की क्लोरीन से अभिक्रिया कराने पर क्लोरीन एक-एक करके मेथेन के चारों हाइड्रोजन परमाणु का प्रतिस्थापन करती है। इसलिए इसे प्रतिस्थापन अभिक्रिया कहते हैं।
CH4 + Cl2 \xrightarrow {सूर्य\,का\,प्रकाश} CH3Cl + HCl
एथेनॉल के भौतिक गुण
- एथेनॉल कक्ष ताप पर द्रव अवस्था में होता है।
- यह जल में घुलनशील है।
- एथेनॉल का गलनांक 156K तथा क्वथनांक 351K होता है।
- इसका उपयोग टिंचर, आयोडीन, कफ सिरप, टॉनिक आदि दवाइयां में होता है।
पढ़ें… कक्षा 10 विज्ञान नोट्स | class 10 science notes in Hindi PDF download NCERT 2024
एथेनॉल के रासायनिक गुण
1. सोडियम के साथ अभिक्रिया – एल्कोहल (एथेनॉल), सोडियम के साथ अभिक्रिया करके हाइड्रोजन गैस उत्सर्जित करता है। तथा सोडियम एथोक्साइड बनता है।
2Na + 2CH3CH2OH \longrightarrow \scriptsize \begin{array}{rcl} 2CH_3CH_2O^-Na^+ \\ सोडियम\,एथोक्साइड \end{array} + H2
2. निर्जलीकरण – 443K ताप पर एथेनॉल को आधिक्य सांद्र सल्फ्यूरिक अम्ल के साथ गर्म करने पर एथेनॉल का निर्जलीकरण हो जाता है। तथा एथीन प्राप्त होती है।
CH3CH2OH \xrightarrow {सांद्र\,H_2SO_4} \scriptsize \begin{array}{rcl} CH_2=CH_2 \\ एथीन \end{array} + H2O
class 10 science chapter 4 notes in Hindi
कार्बन एवं उसके यौगिक कक्षा 10 विज्ञान का अध्याय 4 है। इस अध्याय के अंतर्गत कई महत्वपूर्ण टॉपिक आते हैं। जिन पर वार्षिक परीक्षाओं में प्रशन पूछ लिए जाते हैं। इसलिए आप छात्र इस पाठ के सभी टॉपिक को अच्छे से पढ़ें।
• कार्बन की सर्वतोमुखी प्रकृति क्या है एवं क्यों दर्शाता है
• संतृप्त एवं संतृप्त कार्बनिक यौगिक किसे कहते हैं, उदाहरण, अंतर, सूत्र, हाइड्रोकार्बन
• समजातीय श्रेणी किसे कहते हैं, परिभाषा, उदाहरण, टिप्पणी, विशेषताएं
• एथेनॉइक अम्ल क्या है, भौतिक व रासायनिक गुण, सूत्र, उपयोग, एसीटिक अम्ल