लुईस अम्ल क्षार सिद्धांत
इस सिद्धांत के अनुसार, जो पदार्थ इलेक्ट्रॉन युग्म ग्रहण कर सकता है। उसे अम्ल कहा जाता है और जो पदार्थ इलेक्ट्रॉन युग्म का दान कर सकता है उसे क्षार कहते हैं। अर्थात् इलेक्ट्रॉन युग्म ग्राही अम्ल तथा इलेक्ट्रॉन युग्म दाता क्षारक होते हैं।
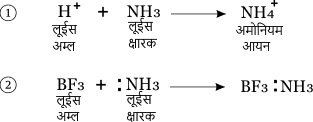
उदाहरण –
AlCl3, Co3+, Mg2+ आदि एक इलेक्ट्रॉन युग्म ग्रहण कर सकती हैं। अर्थात् लुईस अम्ल की भांति व्यवहार करती हैं। जबकि H2O, NH3 तथा OH– आदि एक इलेक्ट्रॉन युग्म का दान कर सकती हैं। अर्थात् लुईस क्षारक की तरह व्यवहार करती हैं।
किसी प्रबल अम्ल का संयुग्मी क्षारक दुर्बल होता है। जबकि किसी दुर्बल अम्ल का संयुग्मी प्रबल क्षारक होता है।
ब्रॉन्स्टेड लोरी क्षारक तथा लुईस क्षारक में कोई ज्यादा विशेष अंतर नहीं है। क्योंकि दोनों ही सिद्धांतों में क्षारक एकाकी इलेक्ट्रॉन युग्म देता है। लेकिन लुईस अम्ल के सिद्धांत के अनुसार कुछ ऐसे पदार्थ भी अम्ल होते हैं जिनमें प्रोटोन उपस्थित नहीं होता है। जैसे BF3 की NH3 से अभिक्रिया जो ऊपर दी गई है। इसका एक उदाहरण है।
पढ़ें… ब्रॉन्स्टेड लोरी का अम्ल क्षार सिद्धांत | Bronsted and Lowery concept in Hindi
इलेक्ट्रॉन युग्म दाता
वह अणु जिसके पास एकाकी इलेक्ट्रॉन युग्म उपस्थित होता है। उस इलेक्ट्रॉन युग्म दाता को लूईस क्षारक कहते हैं। चूंकि वह इलेक्ट्रॉन युग्म दाता का कार्य करता है।
जैसे – H2O, NH3 तथा OH– आदि।
इलेक्ट्रॉन युग्म ग्राही
वह अणु जिसके पास किसी दाता परमाणु से इलेक्ट्रॉन युग्म ग्रहण करने के लिए उचित ऊर्जा के रिक्त कक्षक उपस्थित होते हैं। उस इलेक्ट्रॉन युग्म ग्राही को लुईस अम्ल कहते हैं। यह इलेक्ट्रॉन युग्म ग्राही का कार्य करते हैं।
जैसे – BF3, AlCl3, FeCl3, SiCl4 तथा SO3 आदि।
आशा करते हैं कि लुईस अम्ल क्षार सिद्धांत आपको पसंद आया होगा। यह सिद्धांत ज्यादा महत्वपूर्ण नहीं है बस इसकी परिभाषा और लुईस अम्ल और लुईस क्षारक के एक या दो उदाहरण याद कर लेना एवं यह सिद्धांत ब्रॉन्स्टेड लोरी सिद्धांत से काफी मिलता है तरीका याद रखना।