इस लेख के अंतर्गत हम हैं हेस के नियम का उदाहरण सहित वर्णन करेंगे। तथा इसके अनुप्रयोगों की व्याख्या करेंगे।
हेस का नियम
इस नियम के अनुसार, किसी रासायनिक अभिक्रिया को एक पद में या कई पदों की श्रंखला में कराया जाता है। तो रसायनिक अभिक्रिया में एंथैल्पी परिवर्तन समान रहता है। इसे हेस का नियम (Hess law in Hindi) कहते हैं।
इस नियम को आसानी से इस प्रकार समझा जा सकता है। कि अनेक पदों में होने वाली किसी रासायनिक अभिक्रिया की मानक एंथैल्पी उन सभी अभिक्रियाओं की समान ताप पर मानक एंथैल्पियों के योग के बराबर होती है। जिनमें इस संपूर्ण अभिक्रिया को विभाजित किया जा सकता है।
हेस के नियम के उदाहरण
कार्बन से कार्बन डाइऑक्साइड को निम्न दो विधियों से बनाया जा सकता है।
1. पहले कार्बन को जलाकर एक ही पद में CO2 का निर्माण करना।
माना ∆rH° अभिक्रिया की एंथैल्पी परिवर्तन है।
C(ग्रेफाइट, s) + O2(g) \longrightarrow CO2(g) ; ∆rH° = -393.5 KJ/mol
2. अब कार्बन को वायु की कम मात्रा में जलाते हैं। जिससे पहले CO बनती है। एवं इसके बाद कार्बन डाइऑक्साइड बनती है।
C(ग्रेफाइट) + ½O2(g) \longrightarrow CO(g) ; ∆rH° = -110.5 KJ/mol
CO(g) + ½O2(g) \longrightarrow CO2(g) ; ∆rH° = -283.0 KJ/mol
अतः इन दोनों अभिक्रियाओं के दोनों पदों की ऊष्मा का योग पहली विधि द्वारा प्राप्त कार्बन डाइऑक्साइड के बनने की उष्मा के बराबर है। अर्थात्
-283.0 + (-110.5)
-393.5 KJ/mol
अतः इस प्रकार ∆H एक अवस्था फलन है। जिसका मान इस बात पर निर्भर नहीं करता है। कि अभिक्रिया किस प्रकार की जाए। अतः किसी रासायनिक परिवर्तन हेतु ऊष्मा स्थिर होती है। जो विभिन्न पदों की ऊष्मा के बीजगणितीय योग पर निर्भर करती है।
पढ़ें… एंथैल्पी और एंट्रॉपी की परिभाषा क्या है, एंथैल्पी परिवर्तन किसे कहते हैं मात्रक, सिद्धांत
हेस के नियम के अनुप्रयोग
1. संक्रमण ऊष्मा ज्ञात करने में – एक प्रकार के अपरूपक को दूसरे प्रकार के अपरूपक में परिवर्तित करने में होने वाला ऊष्मा परिवर्तन संक्रमण ऊष्मा को दर्शाता है।
जैसे – सफेद फास्फोरस को लाल फास्फोरस में बदलना।
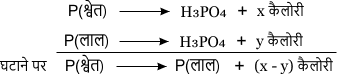
अर्थात् P(श्वेत) को P(लाल) में बदलने के लिए संक्रमण ऊष्मा का मान कैलोरी होगा।
2. उत्पादन ऊष्मा ज्ञात करने में – यदि किसी यौगिक एवं उसके अवयवी तत्वों की दहन ऊष्मा ज्ञात हो, तब इस यौगिक की उत्पादन ऊष्मा की गणना की जा सकती है।
Thanks