कार्बन के अपररूप
कार्बन के क्रिस्टलीय और अक्रिस्टलीय के दो प्रकार के अपररूप होते हैं। हीरा तथा ग्रेफाइट कार्बन के दो प्रमुख क्रिस्टलीय अपररूप हैं एवं तीसरा क्रिस्टलीय अपररूप फुलरीन है।
जबकि चारकोल, काजल, कोक व कार्बन गैस, कार्बन के क्रिस्टलीय अपररूप हैं। कार्बन के तीनों क्रिस्टलीय अपररूप पर वर्णन नीचे किया गया है।
पढ़ें… कार्बन मोनोऑक्साइड क्या है, बनाने की विधि, गुण, उपयोग, फार्मूला तथा प्रकृति
पढ़ें… कार्बन का असंगत व्यवहार तथा महत्वपूर्ण यौगिक और उपयोग बताइए
हीरे की संरचना
हीरा एक अत्यधिक कठोर पदार्थ है। इसमें क्रिस्टलीय जालक होता है। तथा इसमें प्रत्येक परमाणु sp3 संकरित होता है तथा चतुष्फलकीय आकृति में अन्य चार कार्बन परमाणुओं से एक प्रबल सहसंयोजक बंध के द्वारा जुड़ा रहता है। इसमें कार्बन-कार्बन (C—C) बंध की लंबाई 154pm (पीको मीटर) होती है। यह त्रिविम रूप से व्यवस्थित होते हैं। क्योंकि इस प्रकार विस्तृत सहसंयोजक बंध को तोड़ना काफी कठिन है इसलिए पृथ्वी पर पाए जाने वाले पदार्थों में हीरा सर्वाधिक कठोर पदार्थ है।
हीरे पर अम्लों और क्षारों की क्रिया नहीं होती है। हीरे की कठोरता के कारण इसका उपयोग औजारों की तेज धार करने के लिए अपघर्षण के रूप में किया जाता है। तथा इसका उपयोग प्रकाश लैंपो में टंगस्टन धातु के निर्माण में किया जाता है। हीरे की संरचना को चित्र द्वारा प्रदर्शित किया गया है।

ग्रेफाइट की संरचना
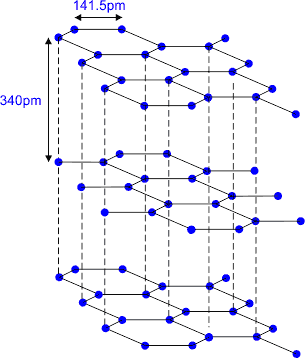
ग्रेफाइट की संरचना परतों के रूप में होती है प्रत्येक परत में एक विशेष कार्बन परमाणु sp2 संकरित होता है। ये परतें दुर्बल वंडरबॉल्स बल द्वारा जुड़ी रहती हैं। दो परतों की बीच की दूरी 340pm (पीको मीटर) होती है। प्रत्येक परत में कार्बन परमाणु षट्कोणीय वलय के रूप में व्यवस्थित होते हैं जिसमें कार्बन कार्बन (C—C) बंध की लंबाई 141.5pm होती है। प्रत्येक कार्बन परमाणु तीन निकटवर्ती कार्बन परमाणुओं से सिग्मा बंध (σ-बंध) बनाता है। तथा कार्बन का चौथा इलेक्ट्रॉन पाई बंध (π-बंध) बनाता है। चूंकि इलेक्ट्रॉन गतिशील होते हैं। इसलिए ग्रेफाइट विद्युत का सुचालक होता है।
ग्रेफाइट क्रियाशील होता है यह 873K ताप पर ऑक्सीजन में जलकर कार्बन डाइऑक्साइड CO2 बनाता है। यह फ्लोरीन से अभिक्रिया करके कार्बन फ्लोराइड बनाता है लेकिन ग्रेफाइट क्लोरीन से अभिक्रिया नहीं करता है।
ग्रेफाइट चिकना तथा मुलायम होता है। इस गुण के कारण ग्रेफाइट का उपयोग कुछ मशीनों में शुष्क स्नेहक के रूप में होता है। तथा यह इलेक्ट्रोड के रूप में तथा लेड पेंसिल के निर्माण में भी प्रयोग होता है।
फुलरीन की संरचना
एच.डब्ल्यू. क्रोटो, ई. स्मैले तथा आर.एफ. कर्ल ने कार्बन के हीरे और ग्रेफाइट के अतिरिक्त एक अन्य अपररूप फुलरीन की खोज की। फुलरीन Cn अणुसूत्र (n = 60, 70 या अधिक) के गोलाकार अणु हैं इसमें C60 अणु सबसे अधिक स्थाई और मुख्य है। C60 को बकमिन्सटर फुलरीन कहते हैं। इसे हीलियम, ऑर्गन आदि अक्रिय गैसों की उपस्थिति में ग्रेफाइट को विद्युत आर्क में गर्म किया जाता है। तब फुलरीन का निर्माण होता है। फुलरीन की संरचना पिंजरा नुमा होती है।
C60 अणु की आकृति सॉकर बॉल के समान होती है। सामान्यतः फुलरीन अणु में 60 कार्बन परमाणु होते हैं। सभी कार्बन परमाणु sp2 संकरित होते हैं। C60 अणु में प्रत्येक कार्बन परमाणु 3 कार्बन परमाणुओं से जुड़ा होता है। और दो एकल बंध तथा एक युग्म बंध बनाता है। फुलरीन की संरचना को चित्र में दर्शाया गया है।
